CNAS+国家CMA二合一扩项现场评审
2022/07/06
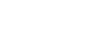

6月24日,微谱药研院·云端直播第6期活动圆满举办,微谱生物分析研究中心技术总监向老师重磅出席,带来题为《生物分析助力药物开发案例分享》的精彩演讲,吸引1712人次线上关注。


生物分析助力药物开发案例分享

向志雄
微谱生物分析研究中心技术总监
上海市生物医药高级工程师
原药明康德生物分析(BAS)创始团队成员
个人简介:超15年的大小分子生物分析和药物代谢动力学研究经验,曾负责开发1000余个化合物的体内生物分析方法,负责过Novartis、GSK、江苏恒瑞、浙江海正、珠海亿邦、微创医疗、华山医院等多家国内外机构的生物分析项目,熟悉国内外GLP生物分析法规要求,多次通过监管机构核查。
曾参与“肾素抑制剂抗高血压重大新药创制”国家科技专项,在国内外学术期刊发表论文20余篇,获国家发明专利多项。
01. 概述
近年来,随着行业的发展,国家药监局颁布了一系列法规和指导原则,法规体系日趋完善,生物分析领域相关法规、原则也逐步体系化。
NMPA法规、指导原则
药物临床试验数据现场核查要点(2015)
生物样本定量分析方法验证指导原则(2020药典)
以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则(2016)
仿制药质量和疗效一致性评价临床试验数据核查指导原则(2017)
药物临床试验数据管理与统计分析的计划和报告指导原则(2016)
药物注册核查要点与判定原则(药物临床试验)(试行)(2022)
FDA
Guidance for Industry-Bioanalytical Method Validation (2011,2018)
EMA
Guideline on Bioanalytical Method Validation (2012)
ICHM10 (2019年2月26日 征求意见中)
【原文】M10:Bioanalytical Method Validation Draft version
【译文】M10:生物样品分析方法验证
从行业规律看,在新药研发的个阶段中,生物分析都提供了不可或缺的数据支撑作用。
在仿制药一致性评价中,生物分析的数据质量直接决定了药品是否能够过评,其重要性可见一斑。
下面,我们围绕5个案例探讨生物分析对药物开发的助力作用。
02. 案例分享
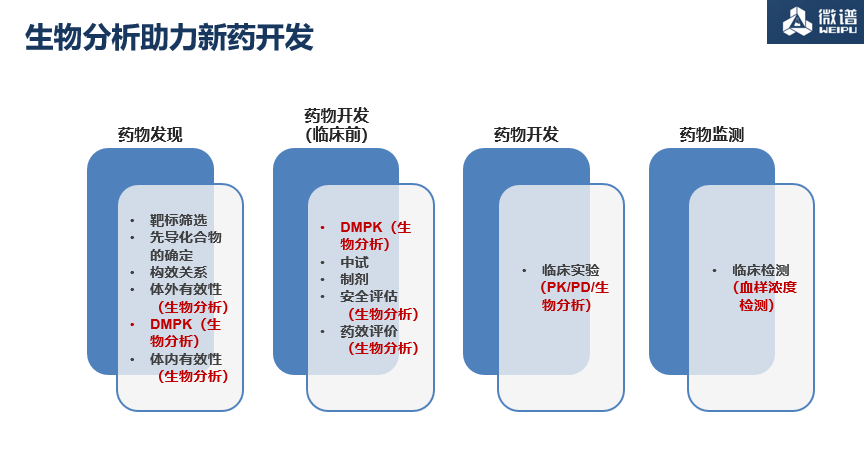
1. 血浆中阿司匹林、水杨酸的检测
阿司匹林和水杨酸标准曲线的配制
本实验采用经无水硫酸钠脱水48小时的含甲酸的乙睛溶解并稀释阿司匹林,采用低温操作,阿司匹林和水杨酸工作溶液分开配制,分别加入到含有KF 的空白血浆,防止阿司匹林降解为水杨酸。
阿司匹林和水杨酸的血样预处理
阿司匹林易降解为水杨酸,本实验采用采血前添加一定量的KF 到采样试管中,并采用低温操作,样品处理采用酸化处理,防止阿司匹林降解为水杨酸。
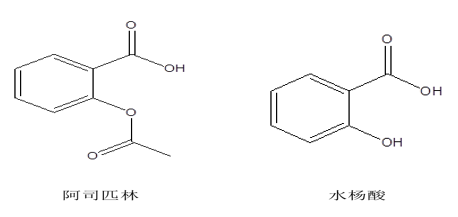
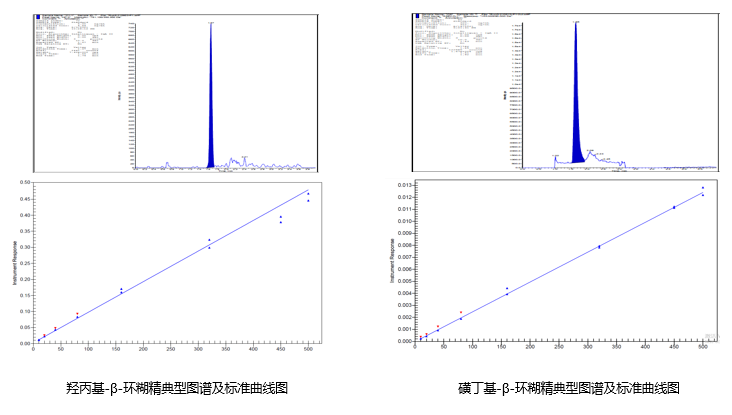
2. LC-MS/MS法测定人血浆中环糊精
磺丁基-β-环糊精(SBECD):1,4-丁院磺内酯与β-环糊精的2-,3-,6-位碳上的羟基发生取代反应而得到的β-环糊精衍生物。
羟丙基-β-环糊精(HP-β-CD):羟丙基与β-环糊精的2-,3-,6-位碳上的羟基发生取代反应而得到的β-环糊精衍生物。
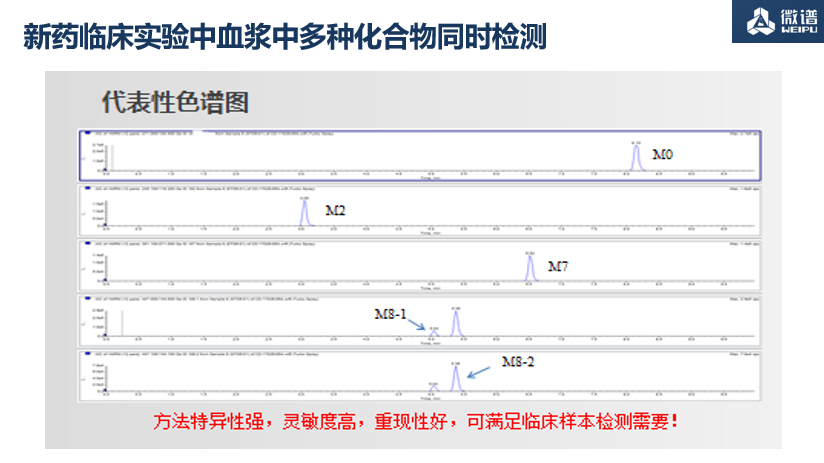
3. 新药临床实验血浆中多种化合物同时检测
LC-MS/MS法同时测定人血浆和尿中某药物及其4中代谢产物的浓度——M0, M2, M7, M8-1 and M8-2。
项目难点
1. 代谢物 M8-1 和 M8-2 顺反异构
2. 化合物极性差异大
3. 化合物灵敏度差异大
4. 系统残留
5. 代谢物无同位素标记内标
解决方案
色谱柱选择
流动相选择
洗针液选择
洗脱梯度设置
ISR检测结果通过率
M0 — 49/51
M2 —— 40/51
M7 —— 50/51
M8-1 —— 50/51
M8-2 —— 46/51
每个化合物均有超出67%的样本ISR结果符合接受标准。
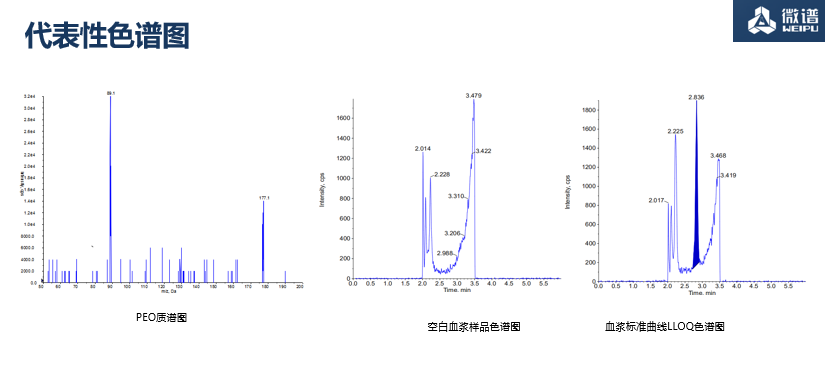
04. 血浆样品中PEO(聚氧化乙烯)的浓度测定
项目重点与难点
平均分子量:1700 KDa,离子化效率差
高分子聚合物 ( CH₂CH₂O )n
背景噪音高,LLOQ要求高 (0.5 µg/mL)
基质干扰大
代表性色谱图
05. 血清中多种激素的检测
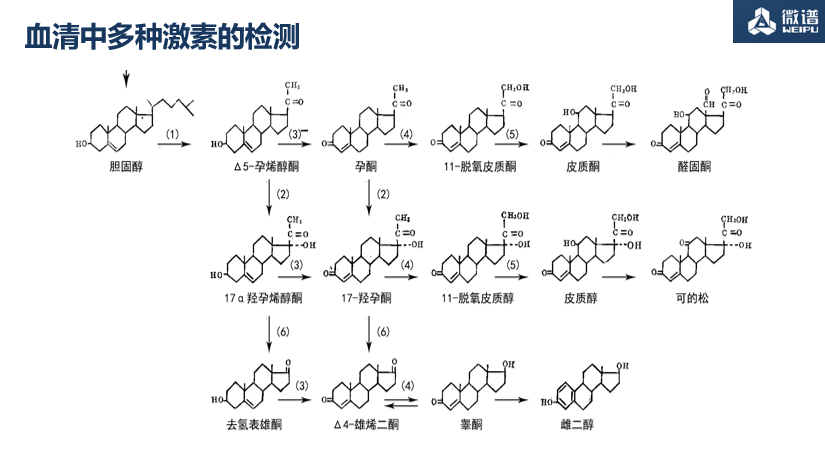
临床中需要检测药物中的激素含量。质谱检测结果呈现的峰形良好,能够实现精确检测,助力药物在临床试验中的开发。
03. 微谱生物分析研究团队
生物分析研究团队拥有数十位专业且熟练的研究人员,大部分来自行业先进的制药、研发公司,具有多年的复杂药物分析方法开发经验,尤其在GLP生物分析、大小分子生物分析、生物等效性等方面有着丰富的项目经验。
生物分析实验室面积超1000㎡,包含样本室、文档档案室、样本档案室、前处理室、标准品室、天平室、仪器室、UPS等区域,专注于临床前及临床大小分子药物和生物标志物方法开发与验证、临床前及临床样品分析、样品长期存储等,具备完备的质量体系,拥有有经过系统验证的仪器设备和电子化系统,可提供符合中西方药物申报要求的临床样品生物分析服务。